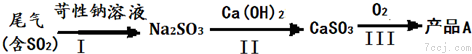
| 测定时间/小时钟 | 1 | 2 | 4 | |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
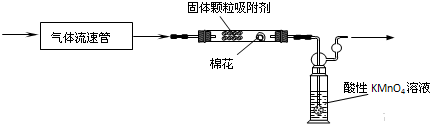
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
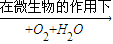 Fe2++SO42-
Fe2++SO42-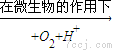 Fe3+
Fe3+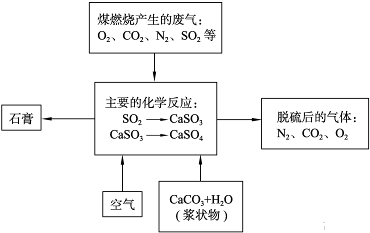
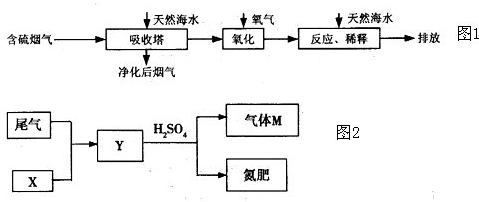
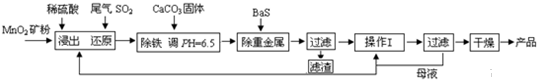
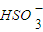 等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.
等分子或离子,使用氧气将其氧化的化学原理是______(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是______.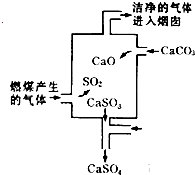
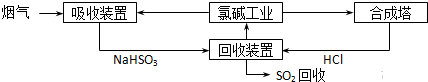
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 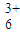 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |