A、如图1所示将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L
B、如图2所示的装置中发生Cu+2Fe3+===Cu2++2Fe2+的反应,X极是负极,Y极的材料名称可以是铜
C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应
D、如图3所示当有0.1mol电子转移时,有0.1molCu2O生成
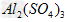 和
和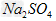 的混合溶液中,
的混合溶液中, =1:2,若
=1:2,若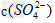 =2.5
=2.5 则
则 为( )
为( ) 
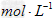

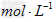
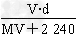

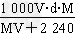

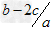 mol/L
mol/L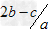 mol/L
mol/L mol/L
mol/L mol/L
mol/L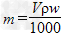


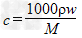


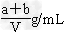
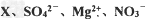 四种离子的无色溶液,要使四种离子的物质的量浓度之比为1:2:1:1,则X应该是( )
四种离子的无色溶液,要使四种离子的物质的量浓度之比为1:2:1:1,则X应该是( ) 

 ( )
( )