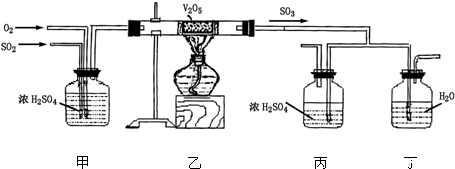
二、 填空题 (共 15 小题)
收 起
(化学-有机化学基础)
下图中X是一种具有水果香味的合成香料,A是有直链有机物,E与FeCl3,溶液作用显紫色.
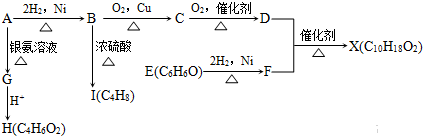
请根据上述信息回答:
(1)H中含氧官能团的名称是______.B→I的反应类型为______.
(2)只用一种试剂鉴别D、E、H,该试剂是______.
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为______.
(4)D和F反应生成X的化学方程式为______.
白磷(P4)分子为正四面体型分子,如图所示,4个P原子位于正四面体的四个顶点,请回答下列问题:
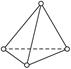
(1)分子中P—P键之间的夹角为__________;
(2)1 mol P4分子中有__________mol P—P键;
(3)P4分子是__________(填极性或非极性)分子。
有机物X、A、B、C、D、E、F、G、H可以发生如下转化.其中C苯环上的一氯代物只有两种,烯烃H与HCl加成生成的产物有两种,D分子中所有的原子不可能均处在同一平面内.
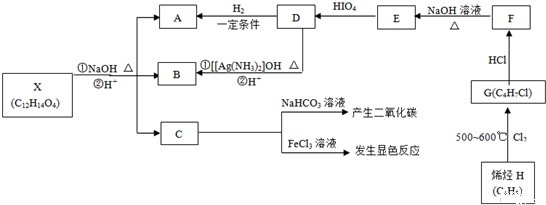
提示: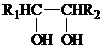 +HIO4→R1CHO+R2CHO+HIO3+H2O
+HIO4→R1CHO+R2CHO+HIO3+H2O
回答下列问题:
(1)C中含氧官能团的名称 ;
(2)写出下列物质的结构简式:
D ,
X ;
(3)写出下列化学反应方程式
①H→G: ;
②F→E: ;
(4)C的另一种同分异构体甲满足以下条件:
①属于芳香族化合物;②苯环上的一氯取代物只有一种;③与足量的NaOH溶液完全反应1mol甲消耗3mol NaOH.
写出甲所有的结构简式: .
根据题目要求书写化学用语:
(1)碳酸氢钠的电离方程式 .
(2)钠和水反应的离子方程式 .
(3)符合CO2+2OH-═CO32-+H2O的化学方程式 .
X、Y、Z是ⅠAⅦA族的三种非金属元素,它们在周期表中的位置如右图所示。试完成下列问题:

(1)X元素单质的化学式是__________。
(2)Y元素的原子结构示意图是__________,Y与Na所形成化合物的电子式为__________。
(3)Z元素的名称是__________,从元素原子得失电子的角度看,Z元素具有__________性;若从Z元素在周期表中所处位置看,它具有这种性质的原因是____________________,其价电子排布式为__________。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是 ,反应结束时,该反应的总反应离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的水溶液显_性,原因(用离子方程式表示)__________________________;它的水溶液中存在多种离子,请写出电荷守恒的等式 。
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物。
现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH-)
_____②中由水电离出的c(OH-)。(填“>”、“=”或“<”)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
。
A、B、C、D四种元素原子核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:
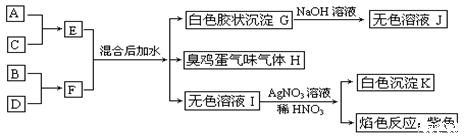
(1)写出四种元素元素符号:A、____B、____C、____D、____。
(2) F的电子式:_________________。
(3)写出E、F混合后加水的离子方程式:_________________________________。
(4)写出G→J的离子方程式:_________________________________。
(5)写出C单质与H水溶液反应的离子方程式:_____________________________。
[化学一选修化学与技术]
纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30〜35C
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转人蒸发皿中灼烧得Na2CO3固体
问题:①反应将温度需控制在30〜35曟,通常采取的加热方法为 ;控制该温度的原因是 .
②静置后只析出NaHCO3晶体的原因是 .
【工业制备纯碱】
③沉淀池中反应的离子方程式为 ;
④循环(I)、循环(II)中物质的化学式分别为 .两种制备纯碱的方法中,共同涉及的化学反应方程式为 .

我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体的实验操作称为______,该装置使用的玻璃仪器有玻璃棒、______、______.
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl-和NH4+,实验室鉴定Cl-所选用的试剂是______,所发生反应的离子方程式为:______;鉴定另一种杂质离子NH4+的实验检验方法是______.
(3)碳酸氢钠晶体受热分解可得到纯碱,其化学反应方程式为______ Na2CO3+CO2↑+H2O
冶金工业上为降低硫的氧化物对空气的污染,常用CO在500℃、铝矾土催化下还原SO2,处理烟道废弃回收硫,写出该反应的化学方程式 。
已知漂白粉与浓盐酸反应可产生氯气[Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O]。某同学试图测定氯气的体积并验证干燥纯净的氯气无漂白性,现有如下装置,请回答:

(1)请用字母填写装置的连接顺序:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)洗气瓶中所装液体是________。
(3)在制氯气前,必须进行的一项操作步骤是________________________________________________________________________。
(4)某同学在实验中,发现量筒中未收集到液体,则失败的原因可能是________________________________________________________________________
________________________________________________________________________。
实验证明铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取CuSO4溶液的。铜屑在此状态下发生的一系列反应的化学方程式为:________________________________________________________________________
________________________________________________________________________。
利用铜与浓硫酸在加热条件下也能制备CuSO4溶液,其化学方程式为________________________________________________________________________。
以上两种方法前者好还是后者好?原因是什么?________________________________________________________________________
________________________________________________________________________。
以下框图中A→M是中学化学中常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体.
请回答下列问题:
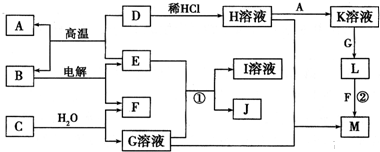
(1)C的电子式为______,C物质中所含化学键类型______.
(2)反应①的离子方程式是:______.
(3)写出B与G溶液反应的离子方程式______.
(4)在I溶液中通入过量CO2反应的化学方程式______.
在下列事实中,什么因素影响了化学反应的速率?
(1)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。 。
(2)同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢。 。
(3)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同。 。
(4)工业上常将固体燃料粉碎进行燃烧。 。
(5)夏天的食品易霉变,冬天就不易发生该现象。 。
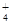
 2MgO+C,该反应属于( )
2MgO+C,该反应属于( ) 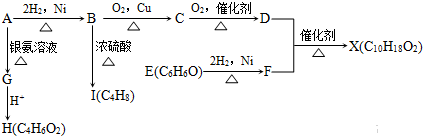


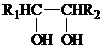 +HIO4→R1CHO+R2CHO+HIO3+H2O
+HIO4→R1CHO+R2CHO+HIO3+H2O


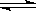 C(g), ΔH < 0;
C(g), ΔH < 0;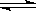 2NH3(g), ΔH < 0;
2NH3(g), ΔH < 0;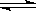 2NO(g) +O2(g),ΔH > 0;
2NO(g) +O2(g),ΔH > 0;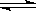 2SO3(g) ,ΔH < 0。
2SO3(g) ,ΔH < 0。 CO2(g) +NO(g),ΔH < 0;
CO2(g) +NO(g),ΔH < 0;