首页 请复制到word或wps中编辑使用(ctrl+c,ctrl+v),vip用户页面底部可看到答案解析 公式上下对齐方法
滴定及离子浓度大小专项
一.单选题
(共 6 小题)
1 . 将pH=8的Ba(OH)2溶液与pH=10的NaOH溶液等体积混合,溶液中氢离子浓度最接近于( )
A、
B、
C、2.0×10-10mol/L
D、10-8mol/L
【答案解析】C
pH=8的Ba(OH)2溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)= ≈
≈ ,
,
则溶液中的c(H+)= =
= =2.0×10-10mol/L,
=2.0×10-10mol/L,
故选C.
2 . 下列溶液中有关物质的量浓度关系正确的是( )。
A、常温下,在pH=8的HCOONa溶液中:c(Na+)-c(HCOO-)=9.9×10-7 mol·L-1
B、Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)
C、室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D、0.1 mol·L-1的NaHC2O4溶液,其pH=4,则c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O4-)
【答案解析】A
3 . 将0.2mol/L的醋酸钠溶液与0.1mol/L盐酸等体积混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是( )
A、c (Ac-)>c (Na+)>c (H+)>c (HAc)
B、c (Na+)+c (H+)=c (Ac-)+c (Cl-)
C、c (Ac-)=c (Cl-)>c (H+)>c (HAc)
D、c (Ac-)>c (Cl-)>c (HAc)>c(H+)
【答案解析】D
4 .
某二元酸H2A在溶液中发生电离:H2A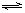 H++HA-,。下列叙述不正确的是( )
H++HA-,。下列叙述不正确的是( )
A、在NaHA溶液中,一定是c(Na+)>c(HA-)>c(OH-)>c(H+)
B、在Na2A溶液中,一定是c(Na+)> c(A2-)>c(OH-)>c(H+)
C、在NaHA溶液中, c(H+)+ c(H2A)=c(A2-)+c(OH-)
D、在H2A溶液中,c(H+)=c(HA-)+c(OH-)+2c(A2-)
【答案解析】A
5 . 草酸是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是( )
A、c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B、c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C、c(C2O42-) < c(H2C2O4)
D、c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
【答案解析】D
6 . 将20mLlmol·L-1的醋酸溶液跟40mL0.5mol·L-1的NaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )。
A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
C、c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D、c(Na+)>c(OH-)>c(H+)>c(CH3COO-)
【答案解析】A
二.解答题
(共 3 小题)
1 .
滴定法是化学定量分析的一种重要而普遍的方法.
I:如图是常温下用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1某一元酸HX溶液所得滴定曲线.
请回答下列问题:
(1)若学生分组实验需用约400mL0.1000mol•L-1NaOH溶液,配制所需溶液时必需的定量玻璃仪器是______.
(2)判断HX是______(填“强酸”或“弱酸”),理由是______
(3)点①所示溶液中,各离子浓度由大到小的顺序是______.
II:某校化学探究小组用高锰酸钾滴定法测定市场上某品牌钙补品中钙的含量.测定的步骤如下:
①取10.00mL样品,加入适量盐酸酸化,再加入足量的沉淀剂草酸铵[(NH4)2C2O4]溶液,然后慢慢滴加氨水,并调节溶液pH至3.5~4.5之间,产生草酸钙沉淀;
②将沉淀放置过夜或加热半小时使沉淀陈化,过滤、洗涤;
③将洗净的沉淀溶解于适量稀硫酸中,加热至75℃~85℃,用0.1000mol•L-1高锰酸钾溶液滴定至终点,记录消耗的高锰酸钾溶液体积;
④重复上述①~③操作,有关数据记录如表.
| 实验 | 样品体积/mL | 高锰酸钾溶液体积/mL |
| 1 | 10.00 | 8.98 |
| 2 | 10.00 | 8.58 |
| 3 | 10.00 | 9.02 |
| 4 | 10.00 | 9.00 |
(2)写出滴定时所发生反应的离子方程式______.
(3)计算样品中钙的含量______g/L.
(4)下列操作会使测量结果偏低的是______.
a.滴定前俯视读数,滴定后仰视读数
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体.

【答案解析】Ⅰ:(1)配制溶液时一定用到容量瓶,体积应和待配溶液体积相接近;
(2)0.1000mol•L-1一元酸HX溶液的PH>1,应为弱酸;
(3)点①所示溶液中,酸过量,溶液呈酸性,
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变;
(2)根据高锰酸钾与草酸发生氧化还原反应书写反应的离子方程式;
(3)根据5CaC2O4~5H2C2O4~2MnO4-计算;
(4)根据关系式c(待测)×V(待测)=c(标准)×V(标准).
Ⅰ:(1)配制溶液时一定用到容量瓶,实验需用约400mL,应用500mL容量瓶,故答案为:500mL容量瓶;
(2)酸的浓度为0.1000 mol•L-1,由图象可以看出0.1000mol•L-1一元酸HX溶液的PH>1,当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,都可以说明HX为弱酸,
故答案为:弱酸;当NaOH溶液滴加至20mL时,溶液pH大于7,或滴加至溶液pH等于7时,需要的NaOH溶液体积小于20mL,或从图中可看出0.1000 mol•L-1 HX的pH大于1;
(3)点①所示溶液中,酸过量,溶液呈酸性,则溶液中存在c(H+)>c(OH-),
根据溶液电中性:c(H+)+c(Na+)=c(X-)+c(OH-),则c(X-)>c(Na+),且c(Na+)>c(H+),
故有c(X-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(X-)>c(Na+)>c(H+)>c(OH-);
Ⅱ:(1)滴定终点,溶液颜色变化,且半分钟内颜色不变,该反应中当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,
故答案为:当最后一滴KMnO4溶液滴入后,溶液由无色变为红色,且半分钟不褪色;
(2)高锰酸钾与草酸发生氧化还原反应,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)第2组数据误差较大,舍去,根据其它三组数据计算,高锰酸钾溶液的平均体积为: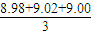 mL=9.00mL,
mL=9.00mL,
5CaC2O4~5H2C2O4~2MnO4-
5mol 5mol 2mol
n 0.1mol/L×9×10-3L
n=2.25×10-3mol,
则m(Ca2+)=2.25×10-3mol×40g/mol=0.09g,
所以1L样品中含有0.09g× =9.00g,
=9.00g,
故答案为:9.00;
(4)a.滴定前俯视读数,滴定后仰视读数,会导致体积偏大,测量结果偏大,故a错误;
b.滴定过程中,不慎将锥形瓶中少量待测液体摇出瓶外,会导致所需标准液偏小,故b正确;
c.滴定前酸式滴定管尖嘴部分有气泡,滴定后尖嘴部分充满溶液,会导致体积读数偏大,测量结果偏大,故c错误;
d.沉淀溶解于稀硫酸时,滤纸上仍残留少量固体,会导致所需标准液偏小,故d正确.
故答案为:b、d.
2 .
某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
步骤Ⅰ准确称取w g食盐样品于烧杯中,加适量蒸馏水使其完全溶解.
步骤Ⅱ用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全.(已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O)
步骤Ⅲ充分反应后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅳ移取25.00mL样品溶液于250mL锥形瓶中,以淀粉溶液为指示剂,用物质的量浓度为2.0×10-3 mol/L的Na2S2O3标准溶液滴定至终点.(已知:I2+2S2O32-=2I-+S4O62-)
按上述操作方法再重复2次.
(1)根据步骤Ⅳ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入Na2S2O3标准溶液进行滴定,则测得样品中碘含量______(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去Na2S2O3标准溶液的体积_____________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.(填序号)
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断步骤Ⅳ中反应恰好完全依据的现象是______.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 16.02 |
| 2 | 25.00 | 2.00 | 11.98 |
| 3 | 25.00 | 0.20 | 10.22 |
【答案解析】(1)①滴定管用蒸馏水洗涤后要润洗,否则相当于溶液被稀释;
②锥形瓶用蒸馏水洗涤后,无需润洗;
③根据滴定过程中眼睛应观察锥形瓶内溶液颜色的变化;
④淀粉遇碘变蓝色,达到滴定终点蓝色褪色,
(2)先根据I2+2S2O32-=2I-+S4O62-求出I2的物质的量,然后再根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
(1)①滴定管用蒸馏水洗涤后要润洗,否则相当于溶液被稀释,则滴定消耗的标准液体积偏大,计算结果待测液浓度的结果偏高,故答案为:偏高;
②锥形瓶用蒸馏水洗涤后,无需润洗,因为有没有谁不影响待测液的物质的量的多少,故答案为:无影响;
③在滴定时,眼睛注视锥形瓶内溶液颜色的变化,故选:B;
④溶液中有碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,
故答案为:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
(2)标准溶液的体积三次消耗的体积分别为:15.00mL,9.98mL,10.02mL,第一组舍去,2、3组标准溶液的体积的平均值为:10.00mL,
I2 +2S2O32-=2I-+S4O62-
1 2
n(I2) 2.0×10-3 mol/L×0.01L
n=1.0×10-5 mol
所以250mL溶液含有I21.0×10-4mol,
根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~KIO3 ~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-4mol
所以m= ×10-5g,
×10-5g,
所以设每千克食盐中含碘 ×10-4g=
×10-4g= g=
g=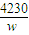 mg/kg,故答案为:
mg/kg,故答案为: .
.
3 .
在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解.试回答下列问题:
(1)FeCl3溶液呈______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,以______ (填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度.
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应______.
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是______.
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的.
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的.
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的.
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的.
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______.
【答案解析】(1)FeCl3为强酸弱碱盐,溶液呈酸性,溶液中存在Fe2++2H2O⇌Fe(OH)2+2H+,加入盐酸,抑制水解;
(2)硫酸铝溶液和碳酸氢钠溶液混合时发生Al3+与HCO3-的互促水解反应;
(3)证明盐的水解是吸热的,应改变溶液的温度,根据溶液pH的变化判断;
(4)AlCl3溶液加热促进水解生成Al(OH)3,灼烧时灼烧分解.
(1)FeCl3为强酸弱碱盐,溶液呈酸性,溶液中存在Fe2++2H2O⇌Fe(OH)2+2H+,加入盐酸,H+浓度增大,抑制水解,
故答案为:酸;Fe2++2H2O⇌Fe(OH)2+2H+;抑制;
(2)硫酸铝溶液和碳酸氢钠溶液混合时,由于Al3+水解呈酸性,HCO3-水解呈碱性,则发生Al3+与HCO3-的互促水解反应,方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)A.反应为中和反应,放热,不能证明水解,故A错误;
B.硝酸铵晶体溶于水吸热,不能证明水解,故B错误;
C.在氨水加入氯化铵固体,铵根离子浓度增大,平衡向逆反应方向移动,溶液的pH变小,不能说明盐类水解是吸热的,故C错误;
D.在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明升高温度平衡向正反应方向移动,可说明盐类水解是吸热的,故D正确.
故答案为:D;
(4)AlCl3溶液加热促进水解生成Al(OH)3,灼烧时Al(OH)3灼烧分解生成Al2O3,故答案为:Al2O3.