首页 请复制到word或wps中编辑使用(ctrl+c,ctrl+v),vip用户页面底部可看到答案解析 公式上下对齐方法
化学选择性必修1-酸或碱溶液相互混合的pH计算
一.单选题
(共 34 小题)
1 . 将pH=8的Ba(OH)2溶液与pH=10的NaOH溶液等体积混合,溶液中氢离子浓度最接近于( )
A、
B、
C、2.0×10-10mol/L
D、10-8mol/L
【答案解析】C
pH=8的Ba(OH)2溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)= ≈
≈ ,
,
则溶液中的c(H+)= =
= =2.0×10-10mol/L,
=2.0×10-10mol/L,
故选C.
2 .
常温下,已知0.01mol/L某酸HA的 ,若在其中加入等体积0.01mol/L的某碱BOH,充分反应后所得溶液的pH值( )
,若在其中加入等体积0.01mol/L的某碱BOH,充分反应后所得溶液的pH值( )
A、pH≤7
B、pH=7
C、pH≥7
D、无法确定
【答案解析】A
根据 和c(H+)×c(OH-)=10-14可知,溶液中
和c(H+)×c(OH-)=10-14可知,溶液中 ,解之得c(H+)=0.01mol/L,故HA为强酸,完全电离,若在其中加入等体积0.01mol/L的某碱BOH,
,解之得c(H+)=0.01mol/L,故HA为强酸,完全电离,若在其中加入等体积0.01mol/L的某碱BOH,
如BOH为强碱,则反应后PH=7,如BOH为弱碱,则反应后PH<7,即混合后PH≤7,
故选A.
3 . 常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液说法正确的是( )
A、混合后溶液pH=7
B、所得混合溶液中c(Na+)>c(CH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C、所得混合溶液中存在c(CH3COOH) =0.05mol/L
=0.05mol/L
D、混合后溶液中存在c(Na+)+c(H+)=
【答案解析】C
常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水,则醋酸和氢氧化钠的物质的量浓度相等,溶液中的溶质是醋酸钠,
A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,故A错误;
B.醋酸钠的水溶液呈碱性,则c(H+)<c(OH-),故B错误;
C.原溶液中c(NaOH)=c(CH3COOH)=0.1mol/L,等体积混合后,体积增大一倍,浓度降为用来的一半,根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.05mol/L,故C正确;
D.混合溶液中存在物料守恒,即c(CH3COOH)+c(CH3COO-)=c(Na+)=0.05mol/L,故D错误;
故选C.
4 . 25℃时,pH=a的HCOOH溶液与pH=b的NaOH溶液等体积混合,所得溶液pH=7,则( )
A、a+b>14
B、a+b=14
C、混合溶液中c(Na+)>c(HCOO-)
D、反应物n(HCOOH)=n(NaOH)
【答案解析】A
A、令甲酸的电离度为α,pH=a的HCOOH溶液浓度为 mol/L,pH=b的NaOH溶液浓度为
mol/L,pH=b的NaOH溶液浓度为 mol/L=10b-14mol/L,甲酸的浓度应大于氢氧化钠的浓度,即
mol/L=10b-14mol/L,甲酸的浓度应大于氢氧化钠的浓度,即 >10b-14,所以1014-a-b<α,故1014-a-b<1,所以a+b>14,故A正确;
>10b-14,所以1014-a-b<α,故1014-a-b<1,所以a+b>14,故A正确;
B、由A分析可知,a+b>14,故B错误;
C、溶液中电荷守恒,则c(Na+)+c(H+)=c(HCOO-)+c(OH-),溶液pH=7,所以c(H+)=c(OH-),故c(Na+)=c(HCOO-),故C错误;
D、若反应物n(HCOOH)=n(NaOH),则反应后溶液为HCOONa溶液,溶液呈碱性,由A分析可知n(HCOOH)>n(NaOH),故D错误.
故选:A.
5 . 若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为( )
A、10:1
B、5:1
C、1:1
D、1:10
【答案解析】B
H2SO4+2NaOH=Na2SO4+2H2O,所以硫酸与氢氧化钠量的比是1:2;设硫酸的物质的量浓度为c,体积为V,氢氧化钠溶液浓度为10-3mol/l,体积为10V,则硫酸与氢氧化钠量的比= =1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1.
=1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1.
故选B.
6 . 常温下,下列有关溶液的说法不正确的是( )
A、某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a
B、将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA)
C、pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-)
D、相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1
【答案解析】C
A.某溶液中水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,说明该物质抑制水电离,则该物质的水溶液呈酸性或碱性,如果溶液呈酸性,溶液中c(OH-)=c(H+)(水电离的)=1×10-amol/L,则溶液的pH=14-a,如果溶液呈碱性,溶液中氢离子浓度就是水电离出的氢离子浓度,则溶液的pH=a,故A正确;
B.酸和碱混合后,溶液中存在物质的量浓度都是0.05mol/L的NaA和HA,根据电荷守恒得
c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得2c(Na+)=c(A-)+c(HA),所以得2c(OH-)+c(A-)=2c(H+)+c(HA),故B正确;
C.该溶液共含有5种离子:Na+、H+、R2-、HR-、OH-,因为两者反应时,H2R稍过量一些,H2R电离出的R2-又很少,所以反应后的溶液中浓度最大的是Na+,故C错误;
D.醋酸是弱电解质,相同温度下,醋酸的浓度越大其电离程度越小,所以0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1,故D正确;
故选C.
7 . 常温下,取0.3mol/L HY溶液与0.3mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
A、混合溶液中由水电离出来的c(OH-)=1×10-9mol/L
B、混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C、c(OH-)-c(HY)=c(H+)=1×10-9mol/L
D、c(Na+)=c(Y-)+c(HY)=0.3 mol/L
【答案解析】C
A.NaY为强碱弱酸盐,水解呈碱性,水解促进水的电离Y-,混合溶液中由水电离出的c(OH-)= mol/L=10-5mol/L,故A错误;
mol/L=10-5mol/L,故A错误;
B.溶液呈碱性,则有c(OH-)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),可得c(Na+)>c(Y-),溶液中离子浓度由大到小的顺序为 c(Na+)>c(Y-)>c(OH-)>c(H+),故B错误;
C.根据物料守恒,应有c(HY)+c(Y-)=c(Na+),根据电荷守恒应有c(Na+)+c(H+)=c(Y-)+c(OH-),二者联式可得:c(HY)+c(H+)=c(OH-),则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1,故C正确;
D.0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,从物料守恒的角度分析,溶液中应存在c(Na+)=c(Y-)+c(HY)=0.15mol•L-1,故D错误.
故选C.
8 . 常温下将KOH溶液与HF稀溶液混合,不可能出现的结果是( )
A、pH=7且c(F-)>c(K+)>c(H+)=c(OH-)
B、pH<7且c(F-)>c(H+)>c(K+)>c(OH-)
C、pH>7且c(K+)+c(H+)=c(F-)+c(OH-)
D、pH>7且c(K+)>c(OH-)>c(F-)>c(H+)
【答案解析】A
A.溶液存在电荷守恒:c(K+)+c(H+)=c(F-)+c(OH-),当pH=7时,c(F-)=c(K+)>c(H+)=c(OH-),故A错误;
B.如HF过量较多,溶液呈酸性,存在c(F-)>c(H+)>c(K+)>c(OH-),故B正确;
C.任何溶液都存在电荷守恒,KOH溶液与HF稀溶液混合后的溶液中存在c(K+)+c(H+)=c(F-)+c(OH-),故C正确;
D.如KOH过量较多,溶液呈碱性,可存在c(K+)>c(OH-)>c(F-)>c(H+),故D正确.
故选A.
9 . 下列实验过程中产生的现象与对应的图形正确的是( )
A、 盐酸中加入Na[Al(OH)4]溶液
盐酸中加入Na[Al(OH)4]溶液
B、 SO2通入溴水中
SO2通入溴水中
C、 向Na2CO3溶液中逐滴滴加HCl
向Na2CO3溶液中逐滴滴加HCl
D、 氨气通入醋酸溶液
氨气通入醋酸溶液
【答案解析】C
A.盐酸滴入NaAlO2溶液中,发生4H++AlO2-=2H2O+Al3+、Al3++3AlO2-+6H2O=4Al(OH)3,消耗盐酸与沉淀的关系与图象不一致,故A错误;
B.溴水溶液的pH<7,SO2气体通入溴水中发生Br2+SO2+2H2O═H2SO4+2HBr,所以pH减小,但图象中开始的pH>7不符合实际,故B错误;
C.向Na2CO3、NaOH溶液中逐滴加入盐酸,则盐酸会先和氢氧化钠发生中和反应,然后是依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,HCl+NaHCO3=NaCl+H2O+CO2↑,和题中图象吻合,故C正确;
D.醋酸为弱电解质,导电能力较弱,氨气通入醋酸中生成醋酸铵,为强电解质,离子浓度增大,导电性增强,而图象中导电性减小,故D错误;
故选C.
10 .
25℃时,在20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,
有关粒子浓度关系的比较中,不正确的是( )
A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B、在B点:c(OH-)═c(H+),c(Na+)═c(CH3COO-)
C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D、在C点:c(CH3COO-)+c(CH3COOH)═2c(Na+)
【答案解析】A
A.在A点氢氧化钠与醋酸恰好完全反应生成醋酸钠溶液,醋酸钠溶液中醋酸根离子会部分水解使溶液呈碱性,所以在A点:离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B.由电荷守恒可知c(CH3COO-)+c(OH-)=c(Na+)+c(H+),因c(OH-)═c(H+),则有c(Na+)═c(CH3COO-),故B正确;
C.在C点醋酸刚好有一半过量,即反应后溶液为等浓度的醋酸钠和醋酸的混合溶液,此时应以醋酸的电离为主,即醋酸的电离大于醋酸根离子的水解,溶液中存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.在C点醋酸刚好有一半过量,由物料守恒可知c(CH3COO-)+c(CH3COOH)═2c(Na+),故D正确.
故选A.
11 . 在25℃时,100mL 0.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值为(已知lg2=0.3)( )
A、0.7
B、1
C、13
D、13.3
【答案解析】C
n(HCl)=0.1L×0.4mol/L=0.04mol,n(NaOH)=0.1L×0.6mol/L=0.06mol,NaOH过量,
则反应后:c(OH-)= =0.1mol/L,
=0.1mol/L,
常温下,c(H+)×c(OH-)=10-14
则c(H+)= mol/L=10-13mol/L
mol/L=10-13mol/L
pH=-lgc(H+)=13,
故选C.
12 .
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
A、a点由水电离出的c(H+)=1.0×10-14mol•L-1
B、b点:c(NH4+)+c=c(Cl-)
C、c点:c(Cl-)=c(NH4+)
D、d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热
【答案解析】C
A、因a点7<pH<14,因此水电离出的c(H+)>1.0×10-14mol•L-1,故A错误;
B、b点时pH>7,则盐酸和氨水反应,氨水过量,则c(NH4+)+c(NH3•H2O)>c(Cl-),故B错误;
C、因c点pH=7溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知c(Cl-)=c(NH4+),故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选:C.
13 . 常温下,将0.06mol/L的H2SO4溶液和0.10mol/L的NaOH等体积混合后,溶液的pH为( )
A、1.7
B、2.0
C、12.0
D、12.3
【答案解析】B
0.06mol/L的H2SO4溶液中c(H+)=0.12mol/L,0.10mol/L的NaOH中c(OH-)=0.1mol/L,等体积混合时酸过量,溶液呈酸性,则反应后c(H+)= =0.01moL/L,
=0.01moL/L,
则pH=2,
故选B.
14 . 常温时,将pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH( )
A、等于7
B、大于7
C、小于7
D、无法判断
【答案解析】B
pH=4的盐酸中c(H+)=10-4mol/L,pH=10的氨水中c(OH-)=10-4mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,则所得溶液的pH>7,
故选B.
15 . 一种一元强酸HA溶液中加入一种一元碱MOH,溶液呈中性,下列判断正确的是( )
A、加入的碱过量
B、生成的盐发生水解
C、反应后溶液中c(A-)=c(M+)
D、混合前酸与碱中溶质的物质的量相等
【答案解析】C
A、如MOH为强碱,则物质的量相等,故A错误;
B、如MOH为强碱,则生成强酸强碱盐,不会水解,故B错误;
C、溶液呈中性,则有c(OH-)=c(H+),根据溶液电中性原则可知c(A-)=c(M+),故C正确;
D、如MOH为弱碱,则碱应过量,混合前酸与碱中溶质的物质的量不等,故D错误.
故选C.
16 . 1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,是该碱溶液的pH等于( )
A、9.0
B、9.5
C、10.5
D、11.0
【答案解析】C
据题意,一元强酸和一元强碱恰好反应,故有H+与OH-的物质的量相等,设强酸的体积为V,则强碱的体积为10V,有V•10-2.5=10V•10PH-14,解得PH=10.5.
故选C.
17 . 中和相同体积相同pH值的Ba(OH)2,NaOH和NH3•H20三种稀溶液所用相同浓度盐酸的体积分别是V1,V2,V3,它们的关系是( )
A、V3>V2>V1
B、V3>V2=V1
C、V3=V2>V1
D、V1=V2>V3
【答案解析】B
NaOH和NH3•H20都是一元碱,Ba(OH)2和NaOH是强碱,NH3•H20是弱碱,pH相同的NaOH和NH3•H20,C(NH3•H20)>C(NaOH),则相同体积相同pH的NaOH和NH3•H20,n(NaOH)<n(NH3•H20),所以需要相同浓度盐酸的体积是V2<V3;
Ba(OH)2和NaOH是强碱,等PH值的Ba(OH)2和 NaOH,氢氧根离子浓度相等,同体积相同PH值的Ba(OH)2和NaOH中氢氧根离子的物质的量相等,所以需要相同浓度盐酸的体积是V1=V2,所以三个体积大小关系是V3>V2=V1,
故选B.
18 . 取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A、0.01mol•L-1
B、0.017mol•L-1
C、0.05mol•L-1
D、0.50mol•L-1
【答案解析】C
设原溶液物质的量浓度为cmol/L,V(NaOH)=3L,V(HCl)=2L,二者混合后反应,混合溶液体积为5L,
二者混合后反应,所得溶液pH=12,则 c(OH-)=10-2mol/L,
3L×cmol/L-2L×cmol/L=10-2mol/L×5L
则c=0.05mol/L
故选C.
19 . 常温下,一定量的醋酸与氢氧化钠溶液发生中和反应,下列说法正确的是( )
A、c =c(Na+)时.该溶液一定呈中性
=c(Na+)时.该溶液一定呈中性
B、c =c(Na+)时,醋酸与氢氧化钠恰好完全中和
=c(Na+)时,醋酸与氢氧化钠恰好完全中和
C、c c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量
c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量
D、c(Na+)>c c(OH-)>c(H+)时,一定是氢氧化钠过量
c(OH-)>c(H+)时,一定是氢氧化钠过量
【答案解析】A
A.根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知,当c(CH3COO─)=c(Na+)时,c(OH-)=c(H+),即溶液显中性,故A正确;
B.若醋酸和氢氧化钠恰好反应,由于生成物醋酸钠水解,溶液呈碱性,应为c(Na+)>c(CH3COO0-),当c(CH3COO─)=c(Na+)时,溶液呈中性,故B错误;
C.由于醋酸为弱酸,当c(H+)>c(OH-),溶液呈酸性,醋酸过量,故C错误;
D.如醋酸和氢氧化钠恰好中和,也满足c(Na+)>c(CH3COO0-)>c(OH-)>c(H+),故D错误.
故选A.
20 . 常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A、V(酸)=102V(碱)
B、V(碱)=102V(酸)
C、V(酸)=2V(碱)
D、V(碱)=2V(酸)
【答案解析】B
强酸溶液pH=a,c(H+)=10-amol/L,强碱溶液pH=b,溶液中氢氧根离子浓度c(OH-)= =10-14+bmol/L;酸碱溶液混合pH=7,则氢氧根离子物质的量等于氢离子物质的量,得到计算式为:c(H+)×V(酸)=c(OH-)×V(碱),
=10-14+bmol/L;酸碱溶液混合pH=7,则氢氧根离子物质的量等于氢离子物质的量,得到计算式为:c(H+)×V(酸)=c(OH-)×V(碱), =
= =
= =10-14+a+b,已知a+b=12,得到
=10-14+a+b,已知a+b=12,得到 =10-2,即100V(酸)=V(碱);
=10-2,即100V(酸)=V(碱);
故选B.
21 . 4体积pH=9的Ca(OH)2溶液跟1体积pH=13的NaOH溶液混合后,溶液中氢离子浓度为( )
A、5×10-13mol/L
B、2×10-12mol/L
C、1/5(4×10-9+1×10-13)mol/L
D、1/5(4×10-5+1×10-1)mol/L
【答案解析】A
4体积pH=9的Ca(OH)2溶液中c(OH-)= =10-5;1体积pH=13的NaOH溶液中c(OH-)=
=10-5;1体积pH=13的NaOH溶液中c(OH-)= =10-1;混合后溶液中氢氧根离子浓度c(OH-)
=10-1;混合后溶液中氢氧根离子浓度c(OH-) ≈2×10-2;
≈2×10-2;
混合溶液中c(H+)= =5×10-13;
=5×10-13;
故选A.
22 . 已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A、a=b
B、混合溶液中,c(H+)= mol/L
mol/L
C、混合溶液的pH=7
D、混合溶液中,c(H+)+c(B-)=c(OH-)+c(A-)
【答案解析】B
A.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故A错误;
B.混合溶液中,c(H+)= mol/L,根据c(H+)•c(OH-)=KW,可知溶液中c(H+)=c(OH-)=
mol/L,根据c(H+)•c(OH-)=KW,可知溶液中c(H+)=c(OH-)= mol/L,溶液呈中性,故B正确;
mol/L,溶液呈中性,故B正确;
C.因温度未知,则pH=7不一定为中性,故C错误;
D.任何溶液都存在电荷守恒,即c(H+)+c(B-)=c(OH-)+c(A-),不能确定溶液的酸碱性,故D错误.
故选B.
23 . 物质的量浓度相同的NaOH和HCl溶液以3:2体积比相混合,所得溶液的pH=12.则原溶液的物质的量浓度为( )
A、0.01 mol•L-1
B、0.017 mol•L-1
C、0.05 mol•L-1
D、0.50 mol•L-1
【答案解析】C
设NaOH和HCl的物质的量浓度均为x,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,
酸碱混合后,pH=12,则碱过量,剩余的c(OH-)=0.01mol/L,
则 =0.01mol/L,
=0.01mol/L,
解得x=0.05mol/L,
故选C.
24 . pH=13的强碱溶液与pH=2的强酸溶液混和,所得混和液的pH=11,则强酸与强碱的体积比是( )
A、11:1
B、9:1
C、1:11
D、1:9
【答案解析】B
pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,
酸碱混合后溶液呈碱性,说明碱过量,且pH=11,说明反应后c(OH-)=0.001mol/L,
则:c(OH-)= =
= =0.001mol/L,
=0.001mol/L,
解之得:V(碱):V(酸)=1:9,
故选B.
25 . 用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
A、V1>V2>V3
B、V1<V2<V3
C、V1=V2>V3
D、V1=V2<V3
【答案解析】D
等体积、等pH的H2SO4、HCl中,c(H+)相同,滴加等浓度的氢氧化钠将它们恰好中和,用去酸的体积V1=V2,但CH3COOH为弱酸,等pH时,其浓度大于HCl,滴加等浓度的氢氧化钠将它们恰好中和,弱酸继续电离产生氢离子,则消耗碱多,即V2<V3,
所以消耗酸的体积关系为V3>V2=V1,
故选D.
26 . 常温下,将10mL pH=3的盐酸溶液中加水稀释后,下列说法正确的是( )
A、溶液中导电粒子的数目减少
B、溶液中的c(OH-)/c(Cl-)不变
C、盐酸的电离程度增大,c(H+)亦增大
D、再加入10mLpH=11的NaOH溶液,混合液pH=7
【答案解析】D
A、溶液中导电粒子的数目不变,浓度减小,故A错误;
B、加水稀释,溶液中氢离子浓度减小,依据离子积常数分析氢氧根离子浓度增大,氯离子物质的量不变;同溶液中体积相同,溶液中的c(OH-)/c(Cl-)增大,故B错误;
C、盐酸是强酸,完全电离,稀释氢离子浓度减小;故C错误;
D、常温下,将10mL pH=3的盐酸溶液中加水稀释后溶液中氢离子物质的量为10-5mol/L,10mLpH=11的NaOH溶液中氢氧根离子物质的量为10-5mol/L,等体积混合恰好中和,混合液pH=7,故D正确;
故选D.
27 . 0.1mol•L-1盐酸分别跟20mL NaOH溶液和20mL氨水完全反应,都消耗了20mL盐酸,这表明NaOH溶液和氨水的关系( )
A、物质的量浓度相同
B、氢氧根离子浓度相同
C、都是强电解质
D、溶液中氢离子浓度相同
【答案解析】A
28 . 酸和碱恰好中和时,它们起反应的( )一定相等.
A、体积
B、物质的量
C、H+和OH-的物质的量
D、物质的量浓度
【答案解析】C
酸碱中和反应的实质为H++OH-=H2O,酸和碱恰好中和时n(H+)=n(OH-),而溶液的体积、溶质的物质的量以及溶质的物质的量浓度相等时都不能确定H+和OH-的物质的量是否相等,
故只有C正确.
故选C.
29 .
9.25℃时,将某一元酸HA和NaOH溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的pH如下表:(假设混合后溶液体积等于混合前两种溶液的体积之和,下同)
| 实验编号 | HA物质的量浓度 (mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
A、第①组所得混合溶液中由水电离出的c(OH-)=1×10-9 mol•L-1
B、第②组中c>0.2,所得混合溶液中离子浓度c(A-)>c(Na+)
C、第③组所得混合溶液中各离子浓度由大到小的顺序是:c(A-)>c(Na+)>c(H+)>c(OH-)
D、25℃时,将0.1mol/L的NaA溶液和0.1mol/L的NaOH溶液等体积混合,所得混合液中A-离子浓度大于第③组所得混合溶液中A-离子浓度
【答案解析】C
A、由表中①组数据可知,一元酸HA和NaOH溶液等体积、等浓度混合,二者恰好反应得到pH=9的NaA溶液中c(H+)=10-9mol/L,依据水的离子积,C(H+)•C(OH-)=10-14,由水电离出的c(OH-)=1×10-5 mol•L-1 故A错误;
B、溶液中一定存在c(OH-)+c(A-)=c(Na+)+c(H+),混合溶液PH=7说明溶液呈中性,c(OH-)=c(H+),所以c(A-)=c(Na+),故B错误;
C、一元酸HA浓度0.2mol/L,和0.1mol/L;0.1mol/LNaOH溶液等体积混合,二者反应后得到等浓度的HA和NaA混合溶液,溶液pH<7,显酸性说明HA的电离大于A-的水解,则c(OH-)<c(H+),c(A-)>c(Na+),所以溶液中离子浓度为c(A-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、将0.1mol/L的NaA溶液和0.1mol/L的NaOH溶液等体积混合,A-离子水解显碱性,氢氧根离子抑制A-的水解,所得混合液中A-离子浓度小于0.1mol/L,③组中混合溶液中HA的电离大于A-的水解,溶液中A-离子浓度大于0.1mol/L,故D错误.
故选C.
30 . 室温时,下列混合溶液的pH一定小于7的是( )
A、pH=3的盐酸和pH=11的氨水等体积混合
B、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C、pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D、pH=3的硫酸和pH=11的氨水等体积混合
【答案解析】C
A、pH=3的盐酸中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故A错误.
B、PH=3的盐酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液c(OH-)=1×10-3mol/L,酸碱都是强电解质,在室温下等体积混合后,pH=7,故B错误;
C、pH=3的醋酸c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液中c(OH-)=1×10-3mol/L,由于醋酸为弱酸,则醋酸过量,在室温下等体积混合后,pH<7,故C正确.
D、pH=3的盐酸中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,D错误.
故选C.
31 . 2009高二上:16.25℃时,下列关于等体积、等pH的NaOH溶液和氨水溶液的说法正确的是( )
A、两溶液OH-浓度:NaOH溶液中大于氨水溶液
B、完全中和所需要相同浓度盐酸的体积:NaOH溶液小于氨水溶液
C、将两溶液温度均升高10℃,两溶液的pH仍相等
D、两种溶液中溶质的物质的量浓度相同
【答案解析】B
A、等体积、等pH的NaOH溶液和氨水溶液中氢氧根离子浓度相同,故A错误;
B、氨水是弱电解质溶液,一水合氨存在电离平衡,完全中和所需要相同浓度盐酸的体积,NaOH溶液小于氨水溶液,故B正确;
C、氨水是弱电解质溶液,加热促进电离溶液pH增大,氢氧化钠溶液加热促进水的电离,溶液pH减小,故C错误;
D、等pH的NaOH溶液和氨水溶液,氨水是弱电解质溶液存在电离平衡,溶质浓度大于氢氧化钠,故D错误;
故选B..
32 . 25℃时,将物质的量浓度相同的NaOH溶液和CH3COOH溶液等体积混合后,下列关系式中不正确的是( )
A、c(OH-)-c(H+)=c(CH3COOH)
B、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C、c(Na+)-c(CH3COO-)=c(OH-)-c(H+)
D、c(Na+)=c(CH3COOH)+c(OH-)
【答案解析】D
物质的量浓度都为0.1mol•L-1的CH3COOH与NaOH溶液等体积混合后,先发生中和反应生成CH3COONa,CH3COONa为强碱弱酸盐,水解呈碱性,则
A.电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(Na+)=c(CH3COOH)+c(CH3COO-),则c(OH-)-c(H+)=c(CH3COOH),故A正确;
B.CH3COONa为强碱弱酸盐,水解呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B正确;
C.电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)-c(CH3COO-)=c(OH-)-c(H+),故C正确;
D.物料守恒为c(Na+)=c(CH3COOH)+c(CH3COO-),故D错误;
故选D.
33 . 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
A、
B、
C、
D、
【答案解析】D
A.氢氧化钠和醋酸发生中和反应,反应放热,当酸反应完成后,再加碱,相当于往热水中加入冷水,温度降低,故A正确;
B.醋酸中滴加氢氧化钠酸性减弱pH增大,当酸碱恰好发生中和时,pH突变,醋酸完全反应后,溶液碱性逐渐增强,故B正确;
C.醋酸中滴加氢氧化钠,相当于弱电解质溶液变成强电解质溶液,因此导电能力增加,故C正确;
D.醋酸中滴加氢氧化钠,氢氧化钠和醋酸发生反应了,当醋酸剩余时,氢氧化钠物质的量0,醋酸中滴加氢氧化钠,即便醋酸完全反应,醋酸钠还是有微弱的水解,醋酸的浓度不可能为0,故D错误.
故选D.
34 .
将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
A、做该实验时环境温度为22℃
B、该实验表明化学能可以转化为热能
C、NaOH溶液的浓度约是1.00 mol/L
D、该实验表明有水生成的反应都是放热反应
【答案解析】B
A.从图示观察起始温度即为实验时环境温度,因此该实验开始时温度是20℃,故A错误;
B.由图示可以看出该反应过程放出热量,表明化学能可能转化为热能,故B正确;
C、恰好反应时参加反应的盐酸体积为30mL,则碱的体积为20mL,c(NaOH)= =1.5mol/L,故C错误;
=1.5mol/L,故C错误;
D.只是该反应放热,其他有水生成的反应不一定,故D错误;
故选B.
二.多选题
(共 4 小题)
1 .
常温下,向20mL x mol•L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化).下列说法中正确的是( )
A、图中V1>20 mL
B、上述 CH3COOH溶液中:c(H+)=1×10-3mol•L-1
C、a点对应的溶液中:c (CH3COO-)=c (Na+)
D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-)
【答案解析】B,C
A.如物质的量浓度都为xmol•L-1的CH3COOH与NaOH溶液等体积混合,则混合后恰好反应生成CH3COONa,CH3COONa为强碱弱酸盐,水解呈碱性,如呈中性,加入NaOH溶液的体积应小于20mL,故A错误;
B.由图象可知,加入NaOH溶液之前,醋酸pH=3,说明c(H+)=1×10-3mol•L-1,故B正确;
C.溶液中存在:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),a点对应的溶液c(OH-)=c(H+),则c(CH3COO-)=c(Na+),故C正确;
D.当加入NaOH溶液的体积为20mL时,恰好反应生成CH3COONa,溶液中存在物料守恒:c(CH3COO-)+c(CH3COOH)=c(Na+),存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),可知联式可得:c(OH-)=c(H+)+c(CH3COOH),故D错误.
故选BC.
2 . 常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )
A、b不可能显碱性
B、a可能显酸性或碱性
C、a不可能显酸性
D、b可能显碱性或酸性
【答案解析】A,B
A、pH为3的某酸溶液,为强酸时与等体积pH为11的氢氧化钠恰好完全反应,生成强酸强碱盐,则溶液为中性;酸为弱酸时酸过量,则溶液一般为酸性,即b不可能显碱性,故A正确;
B、某酸溶液为强酸时与等体积pH为11的氨水反应时氨水过量,则a可能显碱性;若为弱酸时恰好完全反应,生成弱酸弱碱盐,当弱酸酸根离子的水解小于弱碱中离子的水解,则a可能显酸性,故B正确;
C、若为pH=3弱酸与等体积pH为11的氨水恰好完全反应时,生成弱酸弱碱盐,当弱酸酸根离子的水解小于弱碱中离子的水解,则a可能显酸性,故C错误;
D、若酸为pH=3弱酸与等体积pH为11的氢氧化钠溶液反应时酸过量,则溶液一般为酸性,即b不可能显碱性,故D错误;
故选AB.
3 . 常温下将V1mL c1mol/L的NaOH溶液滴加到V2mL c2mol/L的CH3COOH 溶液中,下列结论正确的是( )
A、若V1=V2,c1=c2则溶液一定存在c(H+)=c(OH-)
B、若混合溶液的pH=7,则一定存在c1V1<c2V2
C、若混合溶液的pH=7,则一定存在c(Na+)=c(CH3COO-)
D、若混合溶液的pH>7,则一定是由于NaOH过量造成的
【答案解析】B,C
A、将V1mL c1mol/L的NaOH溶液滴加到V2mL c2mol/L的CH3COOH 溶液混合,若V1=V2,c1=c2,二者恰好完全反应生成CH3COONa,CH3COONa为强碱弱酸盐,溶液呈碱性,
则c(H+)<c(OH-),故A错误;
B、醋酸为弱酸,若c1V1=c2V2时,二者恰好完全反应生成CH3COONa,溶液呈碱性,若混合溶液的pH=7,则一定存在c1V1<c2V2,故B正确;
C、若混合溶液的pH=7,根据溶液呈电中性,溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),故C正确;
D、CH3COONa为强碱弱酸盐,溶液呈碱性,如c1V1=c2V2时,二者恰好完全反应生成CH3COONa,溶液的pH>7,所以若混合溶液的pH>7,NaOH可能过量也可能恰好与CH3COOH反应,故D错误.
故选BC.
4 . 下列有关事实或现象的解释正确的是( )
A、SO2气体能使品红和酸性高锰酸钾溶液褪色,且原理相同
B、氨气可将NO2转化成无毒的物质,是因为氨气具有还原性
C、NH4NO3溶液和HNO3溶液中滴加石蕊都变红色,是因为它们均能电离出H+
D、pH=3的盐酸与pH=11的MOH溶液等体积混合后溶液呈酸性,说明MOH为弱碱
【答案解析】B,D
A、二氧化硫具有漂白性,能使品红褪色,二氧化硫能使酸性高锰酸钾溶液褪色,是因为具有还原性,能被高锰酸钾氧化,SO2气体能使品红和酸性高锰酸钾溶液褪色,原理不相同,故A错误;
B、氨气和二氧化氮之间可以发生氧化还原反应生成无毒物质氮气,体现了氨气的还原性,故B正确;
C、硝酸铵是强酸弱碱盐,其中的铵根离子水解显示酸性,滴加石蕊变红色,HNO3溶液能电离出H+,滴加石蕊变红色,故C错误;
D、只有当MOH是弱碱溶液,pH=11的MOH弱碱溶液的浓度大于pH=3的盐酸的浓度,pH=3的盐酸与pH=11的MOH溶液等体积混合后,碱会剩余,溶液显碱性,如果是强碱时,溶液会显中性,故D正确.
故选BD.
三.填空题
(共 7 小题)
1 .
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图1所示(部分产物已略去).
(1)若A为金属单质,D是某强酸的稀溶液,则反应B+A→C的离子方程式为 .
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则反应 A+D→B的离子方程式为 .
(3)若A为强碱,D为气态酸性氧化物.常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图b所示(不考虑D的溶解和水的挥发).
①若图a符合事实,则D为 (填化学式),此时图a中x 7(填“>”“<”或“=”)
②若图b符合事实,且图b中y<7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 .
【答案解析】(1)若A为金属单质,D是某强酸的稀溶液,A和D反应时,A的量不同生成物不同,则A是变价金属,且A是常见金属,为铁,根据离子方程式的书写规则书写;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,A和不同量的碱反应生成不同的物质,则A是铝盐,铝盐和过量强碱反应生成偏铝酸盐,和少量碱反应生成氢氧化铝,根据离子方程式的书写规则书写;
(3)①若A为强碱,D为气态酸性氧化物.常温时,将B的水溶液露置于空气中,若图a符合事实,说明该酸性氧化物为非还原性酸性氧化物,根据盐的类型确定溶液的pH值大小;
②若图b符合事实,说明该酸性氧化物为还原性酸性氧化物,图b中y<7,B的焰色反应为黄色,说明含有钠元素,则B是亚硫酸氢钠,A是氢氧化钠,C是亚硫酸钠,亚硫酸氢钠是强碱弱酸盐,因其水解而使溶液呈酸性.
(1)若A为金属单质,D是某强酸的稀溶液,A和D反应时,A的量不同生成物不同,则A是变价金属,且A是常见金属,则A为铁,B是铁盐,C是亚铁盐,铁离子和铁反应生成亚铁离子,离子反应方程式为:2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,A和不同量的碱反应生成不同的物质,则A是铝盐,铝盐和过量强碱反应生成偏铝酸盐,和少量碱反应生成氢氧化铝,反应 A+D→B的离子方程式为Al3++4OH-=[Al(OH)4]-,
故答案为:Al3++4OH-=[Al(OH)4]-;
(3)①若A为强碱,D为气态酸性氧化物.常温时,将B的水溶液露置于空气中,若图a符合事实,说明该酸性氧化物为非还原性酸性氧化物,则D为二氧化碳,B是碳酸氢盐,C是碳酸盐,碳酸氢盐是强碱弱酸酸式盐,碳酸氢根离子易水解而使溶液呈碱性,则pH大于7,即x>7,故答案为:>;
②若图b符合事实,说明该酸性氧化物为还原性酸性氧化物,图b中y<7,B的焰色反应为黄色,说明含有钠元素,则B是亚硫酸氢钠,A是氢氧化钠,C是亚硫酸钠,亚硫酸氢钠是强碱弱酸酸式盐,亚硫酸氢根离子的电离程度大于水解程度,钠离子不水解,亚硫酸氢根离子易水解,亚硫酸氢根离子和水都电离出氢离子,所以溶液中离子浓度大小顺序是
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
2 .
水的电离平衡曲线如图所示.
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从______变化到______.
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为______.
(3)已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度.在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积约为______.
【答案解析】(1)Kw=C(H+).C(OH-);
(2)先根据水的离子积常数计算氢氧化钡溶液中C(OH-)、混合溶液中C(OH-),再根据 计算氢氧化钡和盐酸的体积之比;
计算氢氧化钡和盐酸的体积之比;
(3)根据溶解度和密度计算氢氧化钙的物质的量浓度,根据氢氧化钙和钙离子、氢氧根离子之间的关系式计算钙离子浓度、氢氧根离子浓度,再结合离子积常数公式计算离子积.
(1)25℃时纯水中C(H+)=C(OH-)=10-7 mol/L,Kw=C(H+).C(OH-)=10-14 ,当温度升高到100℃,纯水中C(H+)=C(OH-)=10-6 mol/L,Kw=C(H+).C(OH-)=10-12 ;
故答案为:10-14,10-12;
(2)将pH=8的Ba(OH)2溶液中C(OH-)=10-4 mol/L,pH=5的稀盐酸中C(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,混合溶液的pH=7,溶液呈碱性,C(OH-)= =10-5 mol/L,C(OH-)=
=10-5 mol/L,C(OH-)= =10-5 mol/L,x:y=2:9;
=10-5 mol/L,x:y=2:9;
故答案为:2:9;
(3)若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,则100g水中溶解0.74g氢氧化钙时氢氧化钙的C= =0.1mol/L,氢氧化钙是强电解质,所以C(Ca(OH)2)=C(Ca 2+ )=0.1mol/L,C(OH-)=2C(Ca(OH)2)=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=C(Ca 2+ ).C(OH-)2=0.1mol/L×(0.2mol/L)2=4×10-3(mol/L)3;
=0.1mol/L,氢氧化钙是强电解质,所以C(Ca(OH)2)=C(Ca 2+ )=0.1mol/L,C(OH-)=2C(Ca(OH)2)=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=C(Ca 2+ ).C(OH-)2=0.1mol/L×(0.2mol/L)2=4×10-3(mol/L)3;
故答案为:4×10-3.
3 .
某温度下,测得某溶液的pH=6,且氢离子与氢氧根离子物质的量相等,此溶液呈性.则此温度 室温(填高于、低于或等于),其理由是 . 将此温度下pH=10的NaOH溶液aL与pH=1的H2SO4溶液bL混合:
(1)若所得混合液为中性,则a:b= .
(2)若所得混合液的pH=2,则a:b= .
【答案解析】常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,且氢离子与氢氧根离子物质的量相等,此时Kw=10-12,Kw=c(H+)×c(OH-),此温度下pH=10的NaOH溶液中c(OH-)=10-2mol/L,
pH=1的H2SO4溶液中c(H+)=10-1mol/L,以此可解答该题.
常温下中性溶液pH=7,c(H+)=c(OH-)=10-7mol/L,水的电离为吸热过程,升高温度促进水的电离,溶液c(H+)增大,pH=6,c(H+)=c(OH-)=10-6mol/L,此时温度高于常温,
故答案为:高于;水的电离为吸热反应,升温有利于水的电离,使K增大;
(1)此温度下pH=10的NaOH溶液中c(OH-)=10-2mol/L,pH=1的H2SO4溶液中c(H+)=10-1mol/L,
若所得混合液为中性,则有10-2mol/L×aL=10-1mol/L×bL,
则a:b=10:1,
故答案为:10:1;
(2)若所得混合液的pH=2,则有 =10-2mol/L,
=10-2mol/L,
a:b=9:2,
故答案为:9:2.
4 . 将等体积的氨水与盐酸溶液混和后,若混和溶液中[NH4+]=[Cl-],则溶液中的pH值为______7,混和前[NH3•H2O]______[HCl],氨水中[OH-]______盐酸中[H+].(填>、<或=,下同)
【答案解析】根据溶液电中性的原则判断溶液的PH,氨水为弱电解质,如等浓度混合,则反应生成NH4Cl水解呈酸性,而溶液呈中性,则氨水需过量.
反应后溶液呈电中性,则溶液中存在:c(NH4+)+c(H+)=c(Cl-)+c(OH-),因c(NH4+)=c(Cl-),则c(H+)=c(OH-),
所以溶液PH=7,
如等浓度、等体积混合,则完全反应生成NH4Cl,NH4+水解呈酸性,而溶液呈中性,则氨水需过量.所以混合前氨水浓度大于盐酸浓度,即c(NH3•H2O)>c(HCl),
因氨水为弱电解质,且c(NH3•H2O)>c(HCl),如氨水中c(OH-)≥盐酸中c(H+),则反应后溶液呈碱性,
所以氨水中c(OH-)<盐酸中c(H+),
故答案为:=,>,<.
5 .
在某温度下的水溶液中,c(H+)=10x mol•L-1,c(OH-)=10ymol•L-1,x与y关系如图所示.
(1)该温度下,0.01mol•L-1NaOH溶液的pH为______.
(2)在此温度下,将pH=13的NaOH溶液Va L与pH=1的硫酸溶液Vb L混合.
①若所得混合液为中性,则Va:Vb=______.
②若所得混合液的pH=2,则Va:Vb=______.
【答案解析】(1)由图可知,x=-5时,y=-10,x=-10时,y=-5,则该温度下,Kw=10-15,0.01mol•L-1NaOH溶液中c(OH-)=10-2mol•L-1,以此计算;
(2)①所得混合液为中性,则Va L×0.01mol/L=Vb L×0.1mol/L;
②若所得混合液的pH=2,则 =0.01mol/L.
=0.01mol/L.
(1)由图可知,x=-5时,y=-10,x=-10时,y=-5,则该温度下,Kw=10-15,0.01mol•L-1NaOH溶液中c(OH-)=10-2mol•L-1,则c(H+)=10-13mol•L-1,所以pH=13,
故答案为:13;
(2)①所得混合液为中性,则Va L×0.01mol/L=Vb L×0.1mol/L,解得Va:Vb=10:1,故答案为:10:1;
②若所得混合液的pH=2,即酸过量,则 =0.01mol/L,解得Va:Vb=9:2,故答案为:9:2.
=0.01mol/L,解得Va:Vb=9:2,故答案为:9:2.
6 .
下表是常温下,浓度为0.01mol•L-1的NaOH溶液与几种酸或盐混合后的情况:
| 混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
| A | c(HA)=0.02mol•L-1 | 等体积混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液与V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol•L-1 | 等体积混合,pH>7 |
| D | c(NaHD)=0.01mol•L-1 | 等体积混合,pH=7 |
(1)A组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为 ,若pH=8,则c(Na+)-c(A-)= mol•L-1(填具体数字).
(2)由B组混合液pH=7可推知,V1 V2.
(3)C组混合液中,pH>7的原因是 .
(4)0.01mol•L-1NaHD溶液中,水的电离度(已电离的量与初始总量之比)= .
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是 .
【答案解析】(1)A组等体积等浓度混合,得到等量的HA、NaA,pH>7,水解显碱性;pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,则c(Na+)-c(A-)=c(OH-)-c(H+);
(2)若HB为强酸,pH=7,等体积混合;若HB为弱酸,HB的浓度大于0.01mol/L,则酸的体积小可保证pH=7;
(3)酸为二元酸,等体积等浓度混合后,为盐和酸的混合液,溶液pH>7,则盐的水解大于酸的电离;
(4)由等体积等浓度混合pH=7,则NaHD完全电离,c(H+)=0.01mol/L,由水电离出的c(H+)=10-12mol/L,1L水电离出n(H+)=10-12mol,1L水的物质的量为 mol,以此计算电离度;
mol,以此计算电离度;
(5)由上述分析可知,A、C组中的酸不能完全电离,而B组中不能确定,D组中为强酸.
(1)A组等体积等浓度混合,得到等量的HA、NaA,pH>7,水解显碱性,则离子浓度为c(HA)>c(Na+)>c(A-);pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,则c(Na+)-c(A-)=c(OH-)-c(H+)=9.9×10-7mol/L,
故答案为:c(HA)>c(Na+)>c(A-);9.9×10-7;
(2)若HB为强酸,pH=7,等体积混合;若HB为弱酸,HB的浓度大于0.01mol/L,则酸的体积小可保证pH=7,即V1≥V2,故答案为:≥;
(3)酸为二元酸,等体积等浓度混合后,为盐和酸的混合液,溶液pH>7,则盐中HC-的水解大于其电离,故答案为:HC-的水解大于其电离;
(4)由等体积等浓度混合pH=7,则NaHD完全电离,c(H+)=0.01mol/L,由水电离出的c(H+)=10-12mol/L,1L水电离出n(H+)=10-12mol,
1L水的物质的量为 mol,则水的电离度为
mol,则水的电离度为 ×100%=1.8×10-14,故答案为:1.8×10-14;
×100%=1.8×10-14,故答案为:1.8×10-14;
(5)由上述分析可知,A、C组中的酸不能完全电离,而B组中不能确定,D组中为强酸,所以属于弱酸的为HA、H2C,故答案为:HA、H2C.
7 .
25℃时,取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因是: (用离子方程式表示)
(2)混合溶液中由水电离出的c(H+) 0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(3)求混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= mol/L.
【答案解析】(1)25℃时,等体积、等浓度的HA和氢氧化钠恰好反应生成盐,测定混合溶液的pH>7,说明该溶液呈碱性,则该盐是强碱弱酸盐,酸根离子易水解;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(3)根据电荷守恒计算c(Na+)-c(A-).
(1)25℃时,等体积、等浓度的HA和氢氧化钠恰好反应生成盐,测定混合溶液的pH>7,说明该溶液呈碱性,则该盐是强碱弱酸盐,酸根离子易水解,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解离子方程式为:A-+H2O⇌HA+OH-,故答案为:A-+H2O⇌HA+OH-;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离,NaA是含有弱根离子的盐,氢氧化钠是强碱,所以NaA促进水电离,氢氧化钠抑制水电离,则混合溶液中由水电离出的c(H+)>0.1mol/LNaOH溶液中由水电离出的c(H+),故答案为:>;
(3)溶液中存在电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),所以c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L,
故答案为:9.9×10-7.
四.解答题
(共 5 小题)
1 .
常温时,将V1mL c1mol•L-1的氨水滴加到V2mL c2moL•L-1的盐酸中,下列结论中正确的是______
A.若混合溶液的pH=7,则c1V1>c2V2
B.若V1=V2,c1=c2,则溶液中c(NH4+)═c(Cl-)
C.若混合溶液的pH=7,则溶液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则可能有c1═c2.
【答案解析】一水合氨是弱碱,盐酸为强酸,当二者等物质的量反应时生成氯化铵,溶液呈酸性,要使溶液呈中性,氨水应稍过量,结合溶液的电荷守恒解答该题.
A.由于一水合氨是弱碱,要使中和后的溶液为中性,碱应过量才行,故A正确;
B.若V1=V2,c1=c2,则说明氨水与盐酸恰好完全反应,生成氯化氨,因氨根离子水解,故其浓度应小于氯离子,故B错误;
C.溶液中存在电离平衡,有c(H+)+c(NH4+)=c(Cl-)+c(OH-),因溶液pH=7,则c(H+)=c(OH-),c(NH4+)=c(Cl-),故C错误;
D.若pH<7,呈酸性,当V1=V2时,c1=c2也有可能,故D正确.
故答案为:AD.
2 .
相同条件下pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者______后者(填>、<或=,下同=;)
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者______后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者______后者.
【答案解析】(1)醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在电离平衡:CH3COOH⇌CH3COO-+H+,加水稀释促进电离;
(2)从弱电解质的电离平衡移动的角度分析;
(3)相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,加入相同的NaOH,反应后醋酸过量,溶液呈酸性.
(1)因为醋酸为弱酸,相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,水中存在:CH3COOH⇌CH3COO-+H+,加入水使c(H+)浓度减小,平衡右移,又有部分H+被电离出来,当稀释至c(H+)相同时,需要比强酸盐酸更多的水来稀释,故答案为:<;
(2)盐酸是强酸,相应的钠盐的水溶液呈中性,即PH=7,醋酸溶液中存在CH3COOH⇌CH3COO-+H+,加入CH3COONa,溶液CH3COO-浓度增大,抑制醋酸电离,溶液c(H+)减小,所以前者的PH小于后者,故答案为:<;
(3)相同条件下pH=3的盐酸和pH=3的醋酸,醋酸浓度大,取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,盐酸呈中性,而醋酸过量,溶液呈酸性,则盐酸反应后溶液pH大,故答案为:>.
3 .
某温度(t℃)时,水的离子积常数Kw=10-13,则该温度______25℃(填“>”、“<”或“=”),理由是:______.
将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合.
(1)若所得混合液为中性,则a:b=______;
(2)若所得混合液的pH=2,则a:b=______.
【答案解析】常温下,水的离子积常数为Kw=10-14,水的电离为吸热过程,某温度下Kw=10-13,大于10-14,说明水的电离被促进,应升高温度;
此温度下pH=11的NaOH溶液,c(OH-)= mol/L=0.01mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,
mol/L=0.01mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,
(1)若所得混合液为中性,酸碱恰好完全反应;
(2)若所得混合液的pH=2,酸过量,根据c(H+)= 计算.
计算.
常温下,水的离子积常数为Kw=10-14,水的电离为吸热过程,某温度下Kw=10-13,大于10-14,说明水的电离被促进,应升高温度,说明此时水的电离程度高于25℃时水的电离程度,也说明此时的温度高于25℃,
故答案为:>;因为水的电离是吸热的过程,升温有利于水的电离,此温度(t℃)时,水的离子积常数Kw=10-13 大于10-14,说明此时水的电离程度高于25℃时水的电离程度,也说明此时的温度高于25℃;
此温度下pH=11的NaOH溶液,c(OH-)= mol/L=0.01mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,则
mol/L=0.01mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,则
(1)若所得混合液为中性,酸碱恰好完全反应,则有0.01mol/L×aL=0.1mol/L×bL,a:b=0.1:0.01=10:1,
故答案为:10:1;
(2)若所得混合液的pH=2,酸过量,c(H+)= =
= =0.01,
=0.01,
解之得:a:b=9:2,
故答案为:9:2.
4 .
常温下,将某一元酸HA和KOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验 编号 | HA物质的量浓度 | KOH物质的量 浓度 | 混合溶液pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH>7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,若溶液中的离子浓度满足:c(A-)>c(K+)>c(OH-)>c(H+ ),则以上结果______ (选填“正确”或“错误”)
(3)丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序______.
(4)丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算).
c(K+)-c(A-)=______mol•L-1 c(OH-)-c(HA)=______mol•L-1.
【答案解析】(1)酸碱的物质的量相等,如为强酸,反应后溶液呈中性,如为弱酸,反应后溶液呈酸性;
(2)从溶液电中性的角度分析;
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸.
(4)等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=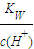 .依据溶液中电荷守恒、物料守恒计算得到.
.依据溶液中电荷守恒、物料守恒计算得到.
(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,溶质为KA,则HA是强酸,如a>7,则HA是弱酸,反应后呈碱性,溶质为KA或KA和KOH,若A-水解程度大于HA酸的电离程度,溶质可以为KA和HA;
故答案为:KA;KA和KOH;KA和HA;
(2)溶液中存在电荷守恒,c(K+)+c(H+ )=c(OH-)+c(A-),c(OH-)>c(H+ )则c(A-)<c(K+),所以c(A-)>c(K+)>c(OH-)>c(H+ )是错误的;
故答案为:错误;
(3)等物质的量的酸碱反应后溶液呈碱性,由于KOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O⇌HA+OH-,则
c(K+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)= =
= =10-5 mol/L,故答案为:10-5.
=10-5 mol/L,故答案为:10-5.
5 .
某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH为11,则该温度下水的Kw=______,此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得溶液为中性,且a=12,b=2,则Va:Vb=______;
(2)若所得溶液为中性,且a+b=12,则Va:Vb=______;
(3)若所得溶液的pH=10,且a=12,b=2,则Va:Vb=______.
【答案解析】根据溶液的pH计算溶液中氢离子浓度,根据氢氧化钠的浓度计算氢氧根离子浓度,再结合Kw=c(H+).c(OH-)计算即可;
(1)混合溶液为中性,则Va L×0.1mol/L=Vb L×0.01mol/L;
(2)所得混合溶液为中性,Va:Vb= =1013-a-b;
=1013-a-b;
(3)所得混合溶液的pH=10,碱过量,则 =0.001mol/L.
=0.001mol/L.
0.01mol•L-1的NaOH溶液的pH为11,则氢离子浓度=10-11 mol/L,氢氧化钠是强电解质完全电离,所以溶液中氢氧根离子浓度是0.01mol/L,则Kw=c(H+).c(OH-)=0.01×10-11=10-13,故答案为:10-13;
(1)该温度下Kw=1.0×10-13,混合溶液为中性,则Va L×0.1mol/L=Vb L×0.01mol/L,解得Va:Vb=1:10,故答案为:1:10;
(2)所得混合溶液为中性,Va:Vb= =1013-a-b;
=1013-a-b;
且a+b=12,解得Va:Vb=10:1,故答案为:10:1;
(3)所得混合溶液的pH=10,碱过量,则 =0.001mol/L.解得Va:Vb=1:9,故答案为:1:9.
=0.001mol/L.解得Va:Vb=1:9,故答案为:1:9.